基本信息
- 中文名称
- 尼达尼布
- 英文名称
- Nintedanib
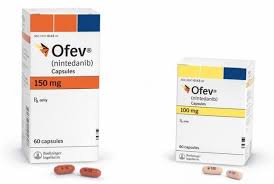
- 商品名
- OFEV
适应症
本品用于治疗特发性肺纤维化(IPF)。
用法用量
应该由具有诊断和治疗IPF经验的医师启动本品的治疗。
本品推荐剂量为每次150 mg,每日两次,给药间隔大约为12小时。
根据患者耐受程度可降低剂量至100mg,每日两次,治疗开始前及给药过程中需定期检查肝功能,一旦出现肝功能异常,应降低剂量或停药(参见【注意事项】、【不良反应】)。
本品应与食物同服,用水送服整粒胶囊。本品有苦味,不得咀嚼或碾碎服用。尚不清楚咀嚼或碾碎胶囊对尼达尼布药代动力学的影响。
如果漏服了一个剂量的药物,应在下一计划服药时间继续服用推荐剂量的药物,不应补服漏服的剂量。不应超过推荐的每日最大剂量300 mg。
剂量调整:
如可适用,除了对症治疗以外,本品的不良反应处理(参见【注意事项】、【不良反应】)可包括降低剂量和暂时中断给药直至特定不良反应缓解至允许继续治疗的水平。可采用完整剂量(每次150 mg,每日两次)或降低的剂量(每次100 mg,每日两次)重新开始本品治疗。如果患者不能耐受每次100 mg,每日两次,则应停止本品治疗。
肝酶升高可能需要调整剂量或中断治疗。天冬氨酸氨基转移酶(AST)或丙氨酸氨基转移酶(ALT)增高在1.5倍正常值上限(ULN)之内,且无中度肝损伤(Child Pugh B)迹象时,可中断治疗,或将本品降低剂量至每次100mg,每日两次。当肝酶恢复至基线值时,重新使用本品降低剂量(每次100mg,每日两次)治疗,随后可增加至完整剂量(每次150 mg,每日两次)。
当AST或ALT>1.5倍ULN,或有中度肝损伤(Child Pugh B)的体征或症状时,应停用本品。
对于轻度肝损伤患者(Child Pugh A级),慎用。
不良反应
1. 安全性概要
尼达尼布已在多个临床试验中对1529例特发性肺纤维化(IPF)患者对进行了研究。以下提供的安全性数据基于涉及1061例患者的对比给予尼达尼布150 mg每日两次和安慰剂的两项为期52周的3期、随机化、双盲、安慰剂对照研究(INPULSIS-1和INPULSIS-2)。与使用尼达尼布相关的最常见不良事件包括腹泻、恶心和呕吐、腹痛、食欲减退、体重下降和肝酶升高。相应的不良反应的管理请参见【注意事项】。按药事管理标准医学术语集(MedDRA)系统器官分类(SOC)提供了不良反应总结和频率分类(如表1)。
表 1 为期52周的两项安慰剂对照组3期临床试验中尼达尼布组(638名患者)或上市后报告的不良药物反应(ADR)的频率汇总表
按照以下频率分类的定义:十分常见:≥1/10;常见:≥1/100至<1/10;偶见:≥1/1,000至<1/100;罕见:≥1/10,000至<1/1,000;十分罕见:<1/10,000;未知(无法从现有数据中估算)。
在每个频率组,不良反应均按照严重程度逐渐降低的顺序列出。
表 1: 按频率分类的ADR总结

1) 该术语代表了一组事件,用来描述一个广义的医学概念,而非单个疾病或某个MedDRA中的首选术语(PT)。
2) 在上市后阶段观察到的非严重及严重的出血事件,其中一部分是致死性的。
特定不良反应的描述
腹泻
有62.4%使用尼达尼布的患者报告发生腹泻。强度为重度的事件占尼达尼布治疗组的3.3%。超过三分之二的患者腹泻的首次发生是在治疗的前三个月。腹泻导致4.4%的患者永久终止治疗,其余患者则通过止泻治疗、降低剂量或中断治疗得以控制该类事件(参见【注意事项】)。
肝酶升高
有13.6%使用尼达尼布的患者报告发生肝酶升高(参见【注意事项】)。肝酶的升高是可逆的,并且不会导致具有临床表现的肝脏疾病。关于一旦出现肝酶升高和腹泻,针对特殊人群、推荐措施和剂量调整的更多信息请参见【注意事项】和【用法用量】。
血小板减少症
血小板减少症可能会发生,导致出血的严重病例已有报道。仔细观察患者,例如定期进行血液测试。如果观察到任何异常情况,应采取适当的措施,比如停止本品的治疗。
2. 在主要临床试验中不良反应的发生情况
由于开展不同的临床试验的条件之间存在较大差异,因而在某一种药物的临床试验中所观察到的不良反应发生率不能与在另一种药物的临床试验中所观察到的发生率直接比较,也无法反映临床实践中所观察到的发生率。
本品的安全性在临床试验的1000多例IPF患者进行了评估,其中包括200多例暴露于本品超过2年的患者。
在三个随机化、双盲、安慰剂对照,为期52周的试验中研究了本品。在一项2期(TOMORROW)和两项3期(INPULSIS-1和INPULSIS-2)试验中,723例IPF患者接受了本品150 mg,每日两次,而508例患者接受了安慰剂。本品治疗患者的中位暴露持续时间为10个月,而安慰剂治疗患者为11个月。受试者年龄在42至89岁之间(中位年龄67岁)。大多数患者为男性(79%)和高加索人(60%)。
接受本品治疗的患者报告的最常见严重不良反应(多于安慰剂组)包括支气管炎(1.2% 对比 0.8%)和心肌梗死(1.5% 对比 0.4%)。接受本品治疗的患者报告的导致死亡的最常见不良事件(多于安慰剂组)包括肺炎(0.7%对比 0.6%)、肺部恶性肿瘤(0. 3%对比 0%)和心肌梗死(0.3%对比0.2%)。在事先定义的包括心肌梗死在内的重大心血管不良事件(MACE)这一类别中,0.6%的接受本品治疗患者和1.8%的接受安慰剂治疗患者报告了致死性事件。
有16%接受本品治疗的患者和1%接受安慰剂治疗的患者报告了导致永久性剂量降低的不良反应。接受本品治疗的患者所报告的导致永久性剂量降低的最常见不良反应是腹泻(11%)。
有21%接受本品治疗的患者和15%接受安慰剂治疗的患者报告了导致停止治疗的不良反应。接受本品治疗的患者所报告的导致停止治疗的最常见的不良反应是腹泻(5%)、恶心(2%)和食欲减退(2%)。
此外,与接受安慰剂治疗的患者相比,接受本品治疗的患者报告的甲状腺功能减退症(1.1% 对比0.6%)较多。
药物相互作用
P-糖蛋白(P-gp)
尼达尼布是P-gp的底物(参见【药代动力学】)。在一项药物相互作用的专项研究中,联合给予P-gp强效抑制剂酮康唑,若按药时曲线下面积(AUC)计,可使尼达尼布暴露量增加至1.61倍,按峰浓度(Cmax)计,可使其暴露量增加至1.83倍。
在一项联合使用P-gp强效诱导剂利福平的药物相互作用研究中,联合使用利福平与单独给予尼达尼布相比,尼达尼布得暴露量按药时曲线下面积(AUC)计下降至50.3%;按峰浓度(Cmax)计下降至60.3%。
如果与本品联合给药,P-gp强效抑制剂(例如,酮康唑或红霉素)可增加尼达尼布暴露量。在这些病例中,应密切监测患者对尼达尼布的耐受性。处理不良反应可能需要中断、降低剂量或停止本品治疗(参见【用法用量】)。
P-gp强效诱导剂(例如,利福平、卡马西平、苯妥英和圣约翰草)可降低尼达尼布暴露量。应考虑选择无P-gp诱导作用的或诱导作用极小的替代性合并用药。
食物
建议本品与食物同时服用(参见【药代动力学】)。
细胞色素(CYP)-酶
尼达尼布的生物转换仅少量依赖CYP途径。在临床前研究中,尼达尼布及其代谢产物(游离酸部分BIBF 1202及其葡糖苷酸化合物BIBF 1202葡糖苷酸)不会抑制或诱导CYP酶(参见【药代动力学】)。因此,认为基于CYP代谢的与尼达尼布发生药物相互作用发生的可能性很低。
与其他药物联合给药
尚未对尼达尼布与激素类避孕药的潜在相互作用进行探索。
尼达尼布具有pH-依赖的溶解特性,在pH<3的酸性环境时,溶解度增加。然而,在临床试验中,与质子泵抑制剂或组胺H2拮抗剂联合给药对尼达尼布的暴露量(谷浓度)没有影响。
抗凝剂
尼达尼布是一种VEGFR抑制剂,可能会增加出血风险。应密切监测接受全剂量抗凝治疗的患者以防出血,必要时调整抗凝治疗。
特定人群使用
儿童人群
尚未在临床试验中研究本品在儿童患者中的安全性和有效性。
老年患者(≥65岁)
与年龄小于65岁的患者相比,未在老年患者中观察到安全性和有效性的总体差异。无需根据患者年龄调整起始剂量。对≥75 岁的患者更有可能需要通过降低剂量的方式来管理不良反应。
人种
基于群体药代动力学(PK)分析,无需调整本品的起始剂量。黑人患者的安全性数据有限。
年龄、体重和性别
根据群体药代动力学分析,年龄和体重与尼达尼布暴露量有关。然而,它们对暴露量的影响不大,无需调整剂量。性别对尼达尼布的暴露量没有影响。
肾损伤
小于1%的单剂量尼达尼布是通过肾脏排泄的。无需对轻度至中度肾损伤患者的起始剂量进行调整。尚未在重度肾损伤(肌酐清除率< 30 ml/min)患者中对尼达尼布的安全性、有效性和药代动力学进行研究。
肝损伤
尼达尼布主要通过胆汁/粪便排泄消除(> 90%);其暴露量在肝损伤患者(Child Pugh A、Child Pugh B)中有所增加。
在轻度肝损伤(Child Pugh A)的患者慎用。
在轻度肝损伤(Child Pugh A)的患者中,在进行不良反应管理时,应考虑中断或停止治疗。
尚未在分类为Child Pugh B和C级的肝损伤患者中进行尼达尼布的安全性和有效性的研究。因此,不建议使用本品对中度(Child Pugh B)和重度(Child Pugh C)肝损伤患者进行治疗。
吸烟者
吸烟与本品的暴露量减少有关。这可能改变本品的疗效。鼓励患者在接受本品治疗前停止吸烟,在使用本品期间应避免吸烟。
- 词条统计
-
- 浏览次数: 2149次
- 最近更新: 2018-08-29
- 创建者: 新垣结衣