基本信息
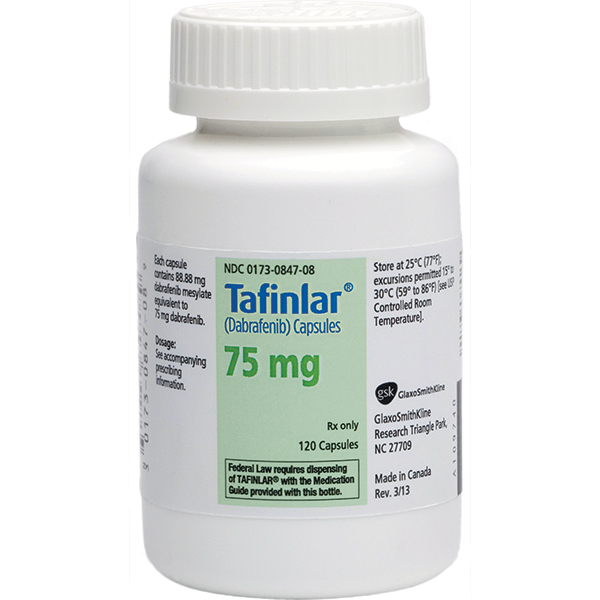
- 商品名
- Tafinlar
- 通用名
- Dabrafenib
- 中文名
- 达拉非尼(甲磺酸达拉非尼胶囊)
- 药企
- GlaxoSmithKline
- 适应症
- 不可切除或已经转移的BRAF V600E基因突变型黑色素瘤,不适用于BRAF野生型黑色素瘤。
- 剂型规格
- 本品为胶囊剂,有50mg和75mg两种规格。推荐剂量为每日2次,每次150mg,饭前1小时或饭后2小时口服。
- 活性成分
- Dabrafenib甲磺酸盐
适应症
BRAF V600E突变阳性不可切除或转移性黑素瘤
TAFINLAR 作为单一药物用于治疗患有BRAF V600E突变且不能切除或转移性黑色素瘤。
BRAF V600E或V600K突变阳性不可切除或转移性黑素瘤
TAFINLAR与trametinib联合用于治疗BRAF V600E或V600K突变的不可切除或转移性黑色素瘤患者。
佐剂治疗BRAF V600E或V600K突变阳性黑色素瘤
TAFINLAR与trametinib联合应用,用于BRAF V600E或V600K突变的黑色素瘤患者的辅助治疗,包括完全切除后淋巴结受累的患者。
BRAF V600E突变阳性转移性NSCLC
TAFINLAR与trametinib联合用于治疗BRAF V600E突变的转移性非小细胞肺癌(NSCLC)患者。
BRAF V600E突变阳性局部晚期或转移性间变性甲状腺癌
TAFINLAR与trametinib联合用于治疗局部晚期或转移性甲状腺未分化癌(ATC)伴BRAF V600E突变,并且没有令人满意的局部治疗选择的患者。
使用限制
TAFINLAR不适用于治疗野生型BRAF患者,包括黑色素瘤、甲状腺癌和非小细胞肺癌。
用法用量
推荐用量不可切除或转移性黑素瘤
TAFINLAR的推荐剂量为每日口服150mg,作为单一药物或与trametinib联合使用,直至疾病进展或不可接受的毒性。
推荐用于辅助治疗黑色素瘤的剂量
TAFINLAR的推荐剂量为150 mg,每日两次与trametinib口服,直至疾病复发或超过1年的不可接受的毒性。
NSCLC推荐剂量
TAFINLAR的推荐剂量为150 mg,每日两次口服,联合trametinib直至疾病复发或不可接受的毒性。
ATC推荐剂量
TAFINLAR的推荐剂量为150 mg,每日两次口服,联合trametinib直至疾病复发或不可接受的毒性。
使用
服用TAFINLAR间隔12h左右。至少在餐前1小时或餐后2小时服用TAFINLAR。
在下一剂TAFINLAR后6小时内不要再次服用TAFINLAR。不要打开,压碎或破坏TAFINLAR胶囊。
警告
新的原发性恶性肿瘤:(包括皮肤恶性肿瘤非皮肤恶性肿瘤)
出血
心肌病
葡萄膜炎
严重的发热反应
严重的皮肤毒性
高血糖
葡萄糖-6-磷酸脱氢酶缺乏症
联合治疗相关的风险
胚胎-胎儿毒性
不良反应
用TAFINLAR治疗的患者最常见的不良反应(≥20%)按发生率递减顺序为:角化过度,头痛,发热,关节痛,乳头状瘤,脱发和手掌跖底感觉异常综合征(PPES)。在研究中导致研究药物永久停药的不良事件发生率,TAFINLAR治疗组为3%,达卡巴嗪治疗组为3%。 导致TAFINLAR剂量减少的最常见(≥2%)不良反应为发热9%,PPES 3%,寒战3%,疲劳2%和头痛2%。
药物相互作用
其他药物对达拉非尼的影响
CYP3A4或CYP2C8的强抑制剂可能会增加达拉菲尼的浓度。TAFINLAR 治疗期间推荐使用CYP3A4或CYP2C8的强抑制剂替代品。如果使用CYP3A4或CYP2C8强抑制剂是不可避免的,那么在服用强抑制剂时应密切监测患者的不良反应。
达拉菲尼对其他药物的影响
达拉菲尼降低了咪达唑仑(一种CYP3A4底物),S-华法林(一种CYP2C9底物)和R-华法林(一种CYP3A4 / CYP1A2底物)的全身暴露。对于接受华法林治疗的患者,在开始或停用达拉菲尼期间,应频繁监测国际标准化比率(INR)。
特定人群使用
怀孕:TAFINLAR会导致胎儿危害。
哺乳期:没有关于人乳中达拉菲尼存在的数据。
生殖潜能的女性和男性:避孕。
儿科用途:TAFINLAR作为单一药物或trametinib的安全性和有效性尚未在儿科患者中确立。
老年人使用:与年轻患者相比,在老年患者中未观察到TAFINLAR的有效性或安全性的整体差异。
肝损害:对于轻度肝损伤患者,不建议调整剂量。
肾脏损害:对于轻度或中度肾功能不全患者,不建议调整剂量。对于严重肾功能不全患者尚未确定合适的剂量。
- 词条统计
-
- 浏览次数: 1810次
- 最近更新: 2018-08-29
- 创建者: